#11 « Mais ça vient d’où, docteur ? Je crois que c’est mon foie »
Étiologie des migraines
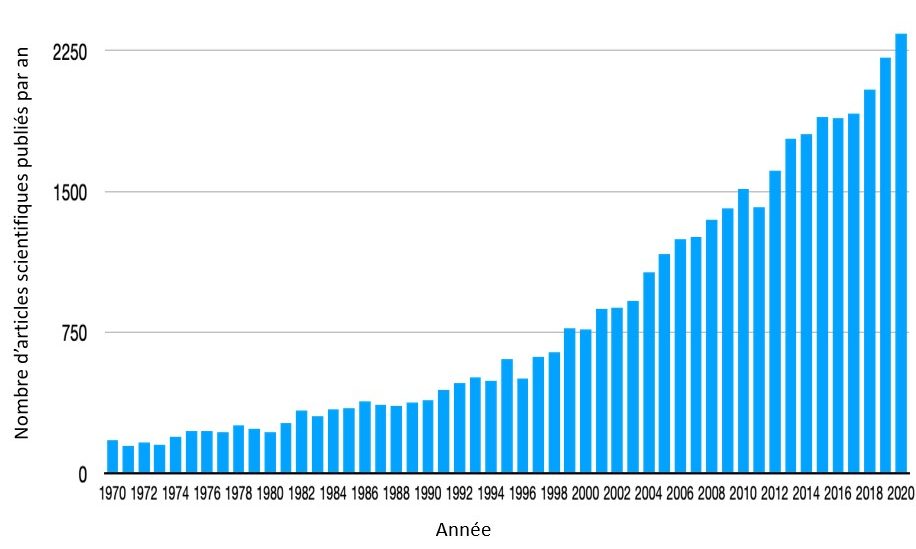
Malgré sa complexité, l’étiologie des migraines commence à être de mieux en mieux connue depuis quelques décennies grâce à la recherche scientifique qui ne cesse de progresser. Une partie non négligeable de ces progrès a été obtenue par deux équipes belges, la nôtre et celle du service de neurologie de l’Université de Gand (professeur Koen Paemeleire), malgré les moyens financiers limités qui leur sont attribués (Fig. 52).
Il est donc faux de prétendre, comme l’a fait vertement un président de parti politique belge, que la migraine est une « terra incognita » dont on ne connaît pas grand-chose.
La prédisposition génétique
Les migraines sont d’abord favorisées par une prédisposition génétique et donc héréditaire. Seule la migraine hémiplégique familiale (MHF) toutefois est causée par une anomalie (« mutation ») dans un seul gène : elle est dite monogénique, à l’image d’autres maladies génétiques comme la dystrophie musculaire de Duchenne ou la mucoviscidose. Trois sous-types de MHF sont connus, chacun lié à une mutation sur un gène d’un chromosome différent : MHF 1 – gène CACNA1A sur le chromosome 19 ; MHF 2 – gène ATP1A2 sur le chromosome 2 ; MHF 3 – gène SCN1A sur le chromosome 1 (Barrett et al., 2008).
Chaque gène permet la synthèse d’une protéine spécifique qui sera anormale en cas de mutation, ce qui se traduit dans les MHF par une excitabilité exagérée du cerveau favorisant la survenue de la dépression corticale envahissante (DCE). La DCE est une décharge brusque et brève des neurones du cortex cérébral suivie par un blocage de leur fonctionnement (« dépression ») qui peut durer plusieurs dizaines de minutes et se propage d’arrière en avant à la surface du cerveau (« envahissante ») (Lauritzen, 2001).
Dans les MHF, la DCE atteint des zones antérieures (frontales) ou profondes (corps striés) d’un hémisphère cérébral impliquées dans les mouvements, ce qui explique la paralysie de la moitié du corps, l’hémiplégie. La DCE est aussi responsable de l’aura dans la migraine avec aura commune (voy. Fig. 10), mais elle reste limitée dans ce cas à la partie postérieure du cerveau et ne provoque que des troubles visuels (le « scotome scintillant ») suivis parfois par des troubles de la sensibilité ou de la parole (voy. Fig. 55).
Les migraines communes avec ou sans aura sont favorisées par un ensemble de particularités génétiques qui varient entre migraineux : ce sont des maladies polygéniques, comme la dépression, la schizophrénie, le diabète, l’athérosclérose, etc. Ces particularités appelées « polymorphismes de nucléotide simple » sont comme des empreintes digitales dans nos gènes et, au contraire des mutations génétiques des MHF qui sont très rares, elles sont fréquentes chez tous les êtres humains. On en a identifié plus de 70 associées à la migraine et il en reste d’autres à découvrir (Choquet et al., 2021).
Ces polymorphismes modifient l’activité de gènes impliqués dans le fonctionnement et le métabolisme du cerveau, mais aussi la sensibilité aux hormones et les réactions inflammatoires (Fig. 53). Ils peuvent aussi être influencés par l’environnement (« modifications épigénétiques ») (Magis et Schoenen, 2012). Pris isolément, chaque polymorphisme intervient pour tout au plus 10 % de la prédisposition génétique.
Il faut un ensemble de polymorphismes génétiques pour que la maladie se déclare. Les types et le nombre des polymorphismes, c’est-à-dire le score de risque polygénique (Chalmer et al., 2018), varient entre migraineux ce qui explique en partie les différences de sévérité de la maladie (voy. supra, # 9) et les différences d’efficacité des traitements (voy. infra, # 13.4).
Figure 53 : Les migraines sont des maladies polygéniques, où un ensemble de gène détermine un seuil de crise
Les particularités génétiques de la migraine déterminent votre seuil migraineux au-delà duquel les crises de migraine apparaissent (Sándor et al., 2001). Si vous en avez hérité beaucoup de vos ascendants vous conférant un score de risque polygénique élevé, vous êtes clairement au-dessus du seuil et vous souffrez d’une migraine sévère (Fig. 53, gènes A+B+C). Si vous en avez moins, votre fréquence de crises est moindre (Fig. 53, gènes B+C).
Si votre score de risque polygénique est faible, vous pouvez rester en dessous du seuil pour toute votre vie (Fig. 53, gène A, gène B). Le seuil migraineux dont vous avez hérité n’est cependant pas stable. Il fluctue spontanément, tout en étant modulé en plus par les facteurs qui aggravent ou améliorent la migraine (voy. supra, # 5). Lorsqu’il baisse par exemple à cause d’influences hormonales ou mentales, les sujets qui jusque-là étaient épargnés par la migraine dépassent le seuil et commencent à faire des crises (Fig. 53, gènes A+C).
À l’inverse, si le seuil migraineux s’élève, par exemple suite à des traitements préventifs efficaces, les migraineux qui étaient proches du seuil voient leur maladie s’améliorer (Fig. 53, gènes B+C), alors que d’autres peuvent n’avoir aucune amélioration parce que leur charge génétique est trop importante ou parce que le traitement n’a pas modifié leur seuil (Fig. 53, gènes A+B+C).
La céphalée migraineuse
Le cerveau est un organe interne, c’est-à-dire un viscère, comme le cœur, les poumons ou le tube digestif. Dans tous les viscères, les fibres nerveuses dites nociceptives, capables de générer un signal « douleur » en cas de risque de lésion, sont localisées non pas dans l’organe lui-même, mais dans ses enveloppes. Ces enveloppes sont le péricarde pour le cœur, la plèvre pour les poumons, le mésentère pour le tube digestif, et ce sont les méninges pour le cerveau (Fig. 54, encart). Les fibres nociceptives des méninges sont en majorité situées autour des vaisseaux, ce qui explique qu’en dehors de leur rôle dans la signalisation d’une douleur, elles peuvent aussi dilater les artères méningées lorsqu’elles sont stimulées.
Leurs corps cellulaires sont contenus dans le ganglion du trijumeau (ganglion de Gasser). Ces neurones ont un axone qui se divise en T en une branche périphérique pour les méninges (système nerveux périphérique) et une branche centrale qui pénètre dans le tronc cérébral inférieur (système nerveux central). Les axones se rassemblent dans la portion viscérale ou profonde de la 1re branche du nerf trijumeau (le nerf ophtalmique ou V1), d’où le nom de système trigéminovasculaire (STV) donné à ce réseau de fibres (Moskowitz, 1984) (Fig. 54, en rouge).
Figure 54 : Le réseau nerveux à la base de la crise de migraine
Les influx nerveux véhiculés par les fibres du STV sont relayés dans le tronc cérébral inférieur et la moelle épinière cervicale supérieure par un noyau, appelé noyau spinal du trijumeau, qui les transmet vers les centres supérieurs dont le thalamus, puis le cortex cérébral somato-sensitif ce qui est nécessaire pour la perception consciente de la douleur et vers le tronc cérébral supérieur où se trouvent des centres de contrôle qui inhibent la douleur par une voie descendante (Fig. 54, en vert).
Or, le noyau spinal du trijumeau relaie aussi des influx venant de fibres nociceptives superficielles (« V1 somatique ») du nerf trijumeau qui innervent le front et des fibres nociceptives qui viennent de la nuque et l’atteignent par la 2e paire (« C2 somatique ») de nerfs spinaux (Fig. 54, en bleu).
Notre cerveau est lui surtout attentif à des informations provenant de la surface du corps et l’aire activée par les influx somatiques (p. ex., ceux venant du front) dans la carte somatotopique du cortex sensitif, notre Google-map, est beaucoup plus grande que celle recevant des informations viscérales (p. ex., du STV) (Fig. 54, cortex sensitif) parce que le nombre de fibres innervant la surface de la tête est de loin supérieur au nombre de fibres venant des organes profonds.
Comme les influx douloureux venant des méninges (via le STV) et les fibres nociceptives somatiques des nerfs V1 et C2 sont relayés par le même centre nerveux (le noyau spinal du trijumeau), vers le cerveau, celui-ci, en se référant à sa carte somatotopique de la surface du corps, localisera erronément la douleur dans le front ou de la nuque.
Ainsi, au cours d’une intervention chirurgicale sur le cerveau, la stimulation des méninges provoque une douleur ressentie à la surface du visage ou du crâne selon l’endroit stimulé (Fig. 54, encart).
La céphalée migraineuse est donc une douleur dite projetée qui définit une douleur ressentie à la surface du corps alors qu’elle naît en profondeur dans un viscère. Ce phénomène explique aussi pourquoi on peut avoir une douleur dans le bras gauche en cas d’angine de poitrine ou d’infarctus du myocarde qui activent des fibres nociceptives provenant du péricarde.
Les fibres nerveuses du STV et leurs corps cellulaires dans le ganglion du trijumeau utilisent, pour communiquer avec leurs cibles et relais, une série de neurotransmetteurs (substances chimiques/« clés » libérées à leur terminaison) et comportent de nombreux récepteurs (protéines des membranes/« trous de serrure ») que viennent activer les neurotransmetteurs.
Parmi ces acteurs de la communication nerveuse, le CGRP (« peptide lié au gène de la calcitonine ») et son récepteur, des sous-types de récepteurs à la sérotonine (5-HT), des récepteurs aux prostaglandines qui interviennent dans l’inflammation et au neuropeptide PACAP (« pituitary adenylate cyclase-activating peptide »), des récepteurs-canaux TRP (« transient receptor potential »), des canaux potassiques BKca (activés par le calcium à grande conductance) ou KATP (sensibles à l’ATP), et un gaz, l’oxyde nitrique (NO), notamment jouent un rôle crucial dans la migraine (Fig. 54).
Les méninges contiennent aussi de nombreux mastocytes, globules blancs qui libèrent notamment de l’histamine et de la sérotonine capables de rendre plus excitables les fibres nociceptives du STV. La modulation expérimentale chez le sujet migraineux de ces différentes molécules déclenche (ou interrompt) une crise de migraine. La majorité des médicaments utilisés pour traiter la crise migraineuse influencent ces transmetteurs et/ou récepteurs, que ce soient les anti-inflammatoires, les triptans, les ditans ou les gépants (voy. infra, # 13.3).
Les gépants et les anticorps monoclonaux qui bloquent l’action du CGRP dans le STV sont en plus capables de prévenir les crises (voy. infra, # 13.4.2). De nouveaux médicaments ciblant d’autres acteurs du STV sont en développement (Ashina, 2020).
Les autres symptômes de la crise migraineuse
Les techniques modernes d’imagerie cérébrale (IRM fonctionnelle, tomographie par émission de positons – TEP) ont permis d’identifier les aires du cerveau qui sont responsables des symptômes de la crise de migraine (Fig. 55).
Figure 55 : Les centres nerveux impliqués dans la crise de migraine
Les prodromes (voy. supra, # 3) sont liés à une activation de l’hypothalamus (Denuelle et al., 2007 ; Schulte et May, 2016), qui est le centre de notre vie végétative et notre horloge biologique, contrôlant notamment la faim (fringales), la soif, le sommeil (bâillements), la libido, le niveau d’énergie (fatigue) et les fonctions hormonales (Fig. 55). Il est possible, mais non encore prouvé, que l’activation hypothalamique soit secondaire à celle du système limbique, en particulier du noyau amygdalien, ce qui expliquerait les modifications émotionnelles de la phase prodromique. L’hypothalamus active ensuite le noyau spinal du trijumeau, mais aussi la portion dorsale du pont où sont situés notamment des centres de contrôle de la douleur (Fig. 54, en vert).
Comme signalé, l’aura migraineuse est provoquée par la dépression corticale envahissante (DCE) dans le centre de la vision d’un hémisphère cérébral, ce qui engendre un scotome scintillant localisé dans la moitié opposée du champ visuel (Charles et Hansen, 2015) (Fig. 55).
Les troubles digestifs qui accompagnent la céphalée s’expliquent par le fait que le centre du vomissement (Fig. 54, en vert clair) et le noyau du nerf vague dans le bulbe rachidien sont contactés par des branches collatérales des axones ascendants du noyau spinal du trijumeau. Ils ne sont pas dus à une maladie du foie, de la vésicule biliaire ou de l’estomac, comme souvent prétendu, mais secondaires au dysfonctionnement du système nerveux végétatif pendant la crise.
Ces collatérales peuvent atteindre aussi le noyau lacrymal (Fig. 54, en magenta) qui contrôle la production de larmes, expliquant que certains migraineux ont, du côté de la céphalée, l’œil rouge et larmoyant. Cette forme de migraine dite « rouge » ne doit pas être confondue avec une algie vasculaire de la face (Obermann et al., 2007) (voy. supra, # 7).
L’allodynie, la sensation désagréable ou même douloureuse induite par le simple toucher du cuir chevelu et des cheveux, est due à une sensibilisation de neurones dans le noyau du trijumeau qui normalement ne sont activés que par une stimulation très forte. C’est notamment favorisé par un déficit d’inhibition de ces neurones par les centres de contrôle de la douleur situés dans la portion supérieure du tronc cérébral (Bogdanov et al., 2015) (Fig. 55).
La photophobie pourrait s’expliquer par la convergence d’influx visuels et d’influx nociceptifs provenant des méninges sur un même centre du thalamus (Fig. 55) qui relaie les informations douloureuses vers le cortex cérébral (Burstein et al., 2019).
Les particularités fonctionnelles du cerveau migraineux entre les crises
À cause du patrimoine génétique dont le migraineux a hérité, son cerveau fonctionne différemment comparé à celui d’un non-migraineux.
La première particularité est qu’il réagit différemment aux stimulations externes et internes. Ceci est illustré dans la figure 56 par l’enregistrement d’un potentiel évoqué visuel.
Si vous fixez la croix jaune du centre, la stimulation de la rétine par l’alternance des carrés noirs et blancs du damier génère dans le centre visuel de votre cerveau une petite activité électrique qu’on peut enregistrer par des électrodes placées sur le cuir chevelu en répétant plusieurs dizaines ou centaines de fois le mouvement du damier : c’est le potentiel évoqué visuel (PEV).
Figure 56 : Le cerveau du migraineux répond différemment à la stimulation lumineuse
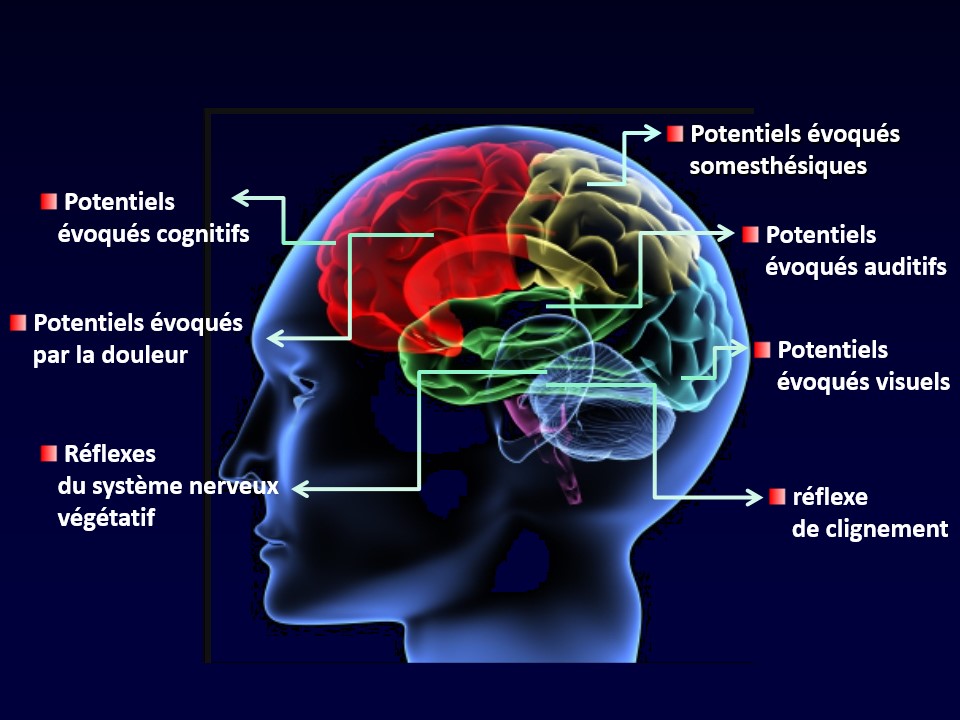
Les enregistrements qui sont montrés ont été obtenus après 600 stimulations ininterrompues ; ils correspondent à la sommation successive de 6 blocs de 100 réponses numérotés de 1 à 6 dans l’ordre d’acquisition du début à la fin de stimulation. Chez le sujet sain (à gauche en rouge), l’amplitude du PEV diminue entre le 1er et le 6e bloc de 100 réponses, c’est-à-dire que la réponse cérébrale s’habitue. À l’inverse, chez le sujet migraineux (à droite en noir), l’amplitude du 6e bloc est plus grande que celle du 1er bloc, c’est-à-dire qu’il n’y a pas d’habituation, même plutôt une augmentation de la réponse (Schoenen et al., 1995). Ce déficit d’habituation du cerveau migraineux est retrouvé pour toute une série de stimulations différentes, auditives, tactiles, douloureuses, mais aussi pour des potentiels cognitifs générés par des activités mentales plus complexes et même dans certains circuits réflexes du tronc cérébral (Ambrosini et al., 2003) (Fig. 57).
Sur le plan comportemental, le déficit d’habituation peut se traduire dans la vie de tous les jours par une difficulté de détourner son attention d’un stimulus qui se répète. Par exemple, supposons que des avions de chasse traversent le ciel lors d’un entraînement militaire. Le sujet non migraineux regardera le 1er, le 2e, peut-être le 3e, puis détournera le regard pour s’occuper d’autre chose.
Le migraineux, par contre, regardera jusqu’au dernier, même s’il y en a une vingtaine. Cette tendance à laisser détourner son attention par des stimuli répétitifs sans intérêt peut perturber l’adulte migraineux dans son travail et l’enfant migraineux dans l’apprentissage.
Mis à part son rôle dans la mémoire, l’habituation est un phénomène physiologique qui permet au cerveau d’économiser de l’énergie. La manière dont les migraineux traitent les informations sensorielles est dès lors nettement plus « énergivore » (Schoenen, 1996).
La seule modalité sensorielle pour laquelle l’habituation est normale chez le migraineux est l’olfaction. Or, les influx olfactifs sont les seuls à ne pas être relayés par le thalamus (voy. Fig. 55) avant d’atteindre le cortex cérébral, ce qui conforte l’hypothèse selon laquelle le déficit d’habituation est dû à un dysfonctionnement des connexions entre le thalamus (voy. Fig. 55) et le cortex, appelé dysrythmie thalamo-corticale (Coppola et al., 2020).
L’hyperréactivité cérébrale peut parfois être détectée à l’électroencéphalogramme (EEG), un examen routinier en neurologie qui enregistre l’activité électrique produite par le cerveau, à condition de réaliser une stimulation lumineuse à 20 flashs par seconde et une analyse quantitative de l’EEG. On enregistre alors chez bon nombre de migraineux, en regard des aires visuelles du cerveau, une activation électrique importante à 20 cycles par seconde, c’est-à-dire à la fréquence de la stimulation lumineuse, ce qui n’est pas le cas chez les non-migraineux (Fogang et al., 2015).
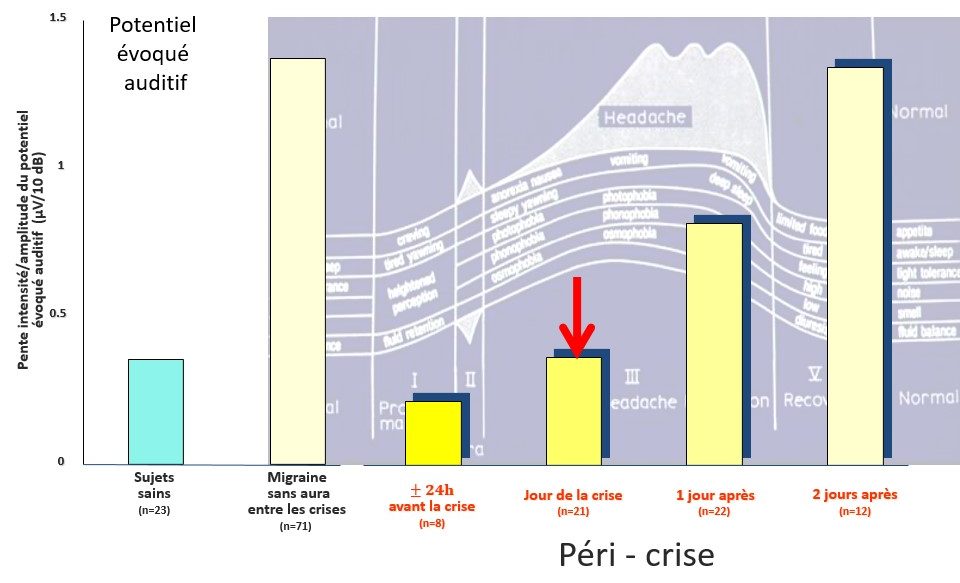
Les particularités du traitement des informations sensorielles par le cerveau des migraineux ne sont pas stables, mais fluctuent au long du cycle migraineux. Elles sont les plus marquées à distance d’une crise, tendent à s’effacer juste avant la crise et disparaissent pendant la crise, ce qui est illustré dans la figure 58 par le potentiel évoqué auditif que nous avons enregistré à différents moments du cycle migraineux (Àfra et al., 2000).
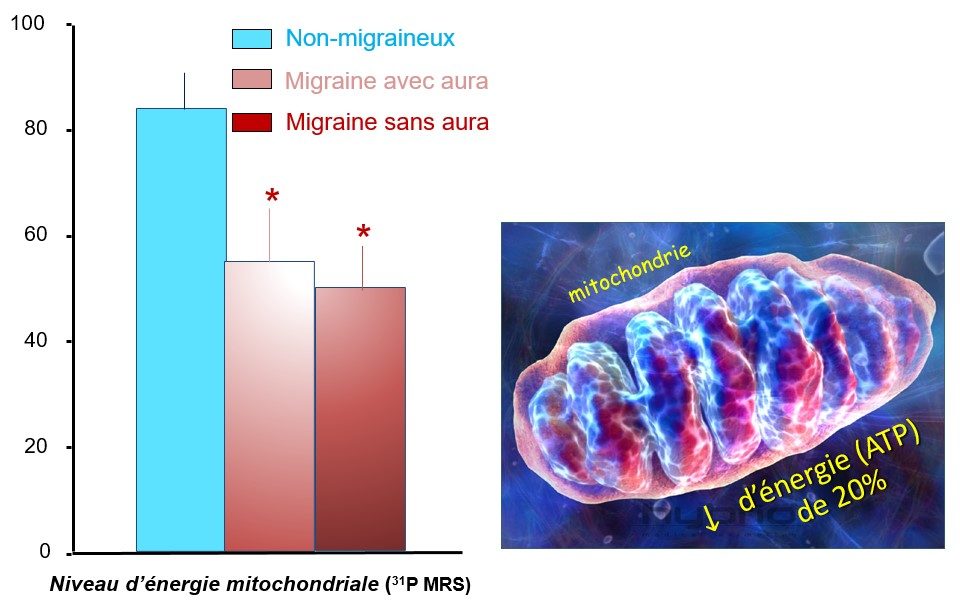
La deuxième particularité du cerveau des migraineux est qu’il manque d’énergie (Gross et al., 2019). Les mitochondries, centrales énergétiques de la cellule, fonctionnent moins bien chez les migraineux et produisent moins d’adénosine triphosphate (ATP) à partir du sucre (glucose) que nous mangeons et de l’oxygène que nous inspirons. L’ATP est le carburant des neurones et indispensable à leur fonctionnement correct. Il est diminué de près de 20 % dans le cerveau des migraineux (Reyngoudt et al., 2011) (Fig. 59).
La figure 60 illustre cette combinaison du travail excessif du cerveau et de la diminution de sa réserve énergétique en montrant les résultats d’enregistrements que nous avons faits pendant une stimulation lumineuse dans le centre visuel des mêmes sujets, d’une part, de l’activité neuronale par le potentiel évoqué visuel (PEV), d’autre part, de la captation de sucre (glucose) par tomographie d’émission de positons (TEP). À gauche de la diagonale, les sujets non migraineux (en bleu) ont une réserve énergétique suffisante (ordonnée/axe y-vert) pour le travail effectué par les neurones (abscisse/axe x-orange) ; ils se trouvent en majorité dans le quadrant supérieur gauche du graphique, celui d’une activité neuronale relativement modeste pour une captation de sucre maximale. En revanche, les migraineux (en rouge) sont situés presque tous dans la zone rose à droite de la diagonale, et surtout dans le quadrant inférieur droit, où le travail cérébral est maximal et la réserve d’énergie faible.
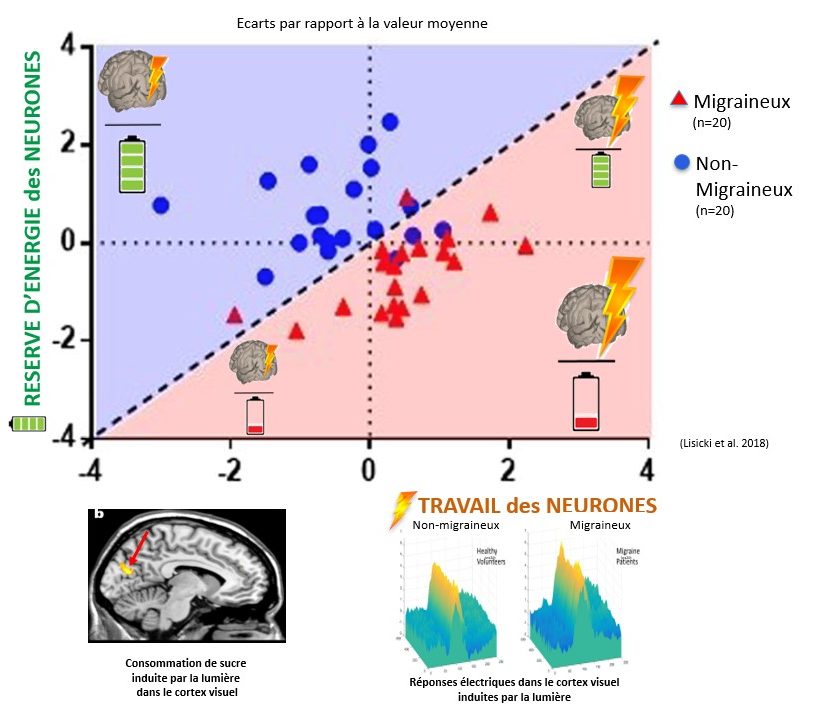
Notez cependant que tous les migraineux n’entrent pas dans le même moule : certains migraineux ont une réserve d’énergie effondrée et une activation neuronale relativement faible ; quelques-uns se caractérisent à l’inverse par une hyperactivation neuronale mais une réserve énergétique normale (Lisicki et al., 2018). Comme les études génétiques le suggéraient déjà, ceci confirme que les mécanismes cérébraux à la base de la migraine ne sont pas homogènes ; ils peuvent différer entre migraineux, ce qui explique aussi pourquoi l’efficacité des traitements diffère (voy. infra, # 13).
Pour expliquer les particularités du cerveau chez le migraineux, j’utilise souvent en consultation la métaphore de l’automobile (Schoenen, 1994) (Fig. 61). Le cerveau du migraineux est hyperréactif, s’emballe pour un rien et ne s’arrête jamais : il peut être comparé à un moteur puissant et nerveux, par exemple celui d’un constructeur italien célèbre.
Figure 61 : La « métaphore de l’automobile »
Malheureusement, il fonctionne avec une réserve d’énergie réduite, c’est-à-dire avec un petit réservoir de carburant comparable à celui d’une petite voiture française populaire de collection. Cette inadéquation peut conduire dans certaines circonstances à un déséquilibre métabolique du cerveau, c’est-à-dire à un stress oxydatif, qui peut être comparé à une panne d’essence.
Le déséquilibre métabolique est un signal de danger et, via la dépression corticale envahissante (DCE) et/ou par l’intermédiaire de cellules nerveuses sensibles aux variations métaboliques, comportant des canaux ioniques modulés par l’ATP (diminué) ou l’acidité (augmentée), il peut dès lors activer le principal système neuronal qui permet au cerveau de dire « j’ai mal », le système trigéminovasculaire, ce qui déclenche la crise de migraine. Cette métaphore permet aussi de comprendre les principaux facteurs déclenchants ou aggravants des crises : l’excès de travail cérébral (p. ex., à cause du stress accumulé ou d’une activité professionnelle prolongée) ou la déplétion plus marquée des réserves énergétiques (p. ex., à cause d’un manque de sommeil et de repos, d’un repas manqué, d’une hypoglycémie ou d’un manque d’oxygène).

