#15 « Est-ce que je dois prendre un médicament tous les jours ? »
Les traitements préventifs (ou de fond) médicamenteux
#15.1 Indications d’un traitement préventif
L’indication et le type du traitement préventif antimigraineux doivent être choisis en tenant compte du profil individuel de chaque migraineux (Fig. 68).
Il existe néanmoins un consensus international sur les indications suivantes d’un traitement préventif (ou traitement de fond) (Ducros et al., 2021 ; Eigenbrodt et al., 2021) :
- avoir plus de deux crises par mois ;
- souffrir d’une migraine sévère (voy. Fig. 36) ;
- ne pas avoir de traitement efficace et bien toléré des crises ;
- être à risque de développer des céphalées par surconsommation médicamenteuse à cause de la prise fréquente d’antimigraineux de crise.
Les médicaments préventifs de la migraine appartiennent à des classes pharmacologiques très différentes et le mécanisme d’action précis de la plupart d’entre eux n’est pas connu (Fig. 74). À l’exception des nutraceutiques (compléments nutritionnels utilisés comme traitements) (Lisicki et Schoenen, 2020), tous les médicaments préventifs classiques peuvent avoir des effets indésirables gênants variant d’un médicament à l’autre (Silberstein et al., 2012). Il est important d’en informer le sujet, car ces effets secondaires sont réversibles à l’arrêt du traitement et donc sans danger. Le bénéfice de l’information sur l’anxiété du patient et son adhérence au traitement dépasse largement le risque d’effet nocebo (voy. « préambule ») (Mitsikostas et al., 2011).
Pour minimiser les effets secondaires, il est recommandé de commencer par une petite dose du médicament et de l’augmenter progressivement jusqu’à la dose minimale efficace et bien tolérée. Sauf exception (voy. infra, # 13.4.2), l’effet bénéfique sur la fréquence et l’intensité des crises n’apparaît qu’après plusieurs semaines ou mois de traitement ; il ne faut pas dès lors arrêter ou changer le traitement trop vite. Les anticonvulsivants ont d’habitude l’effet le plus rapide. Parmi eux, la lamotrigine occupe une place particulière : elle est très efficace sur les auras migraineuses, mais inefficaces sur la migraine sans aura.
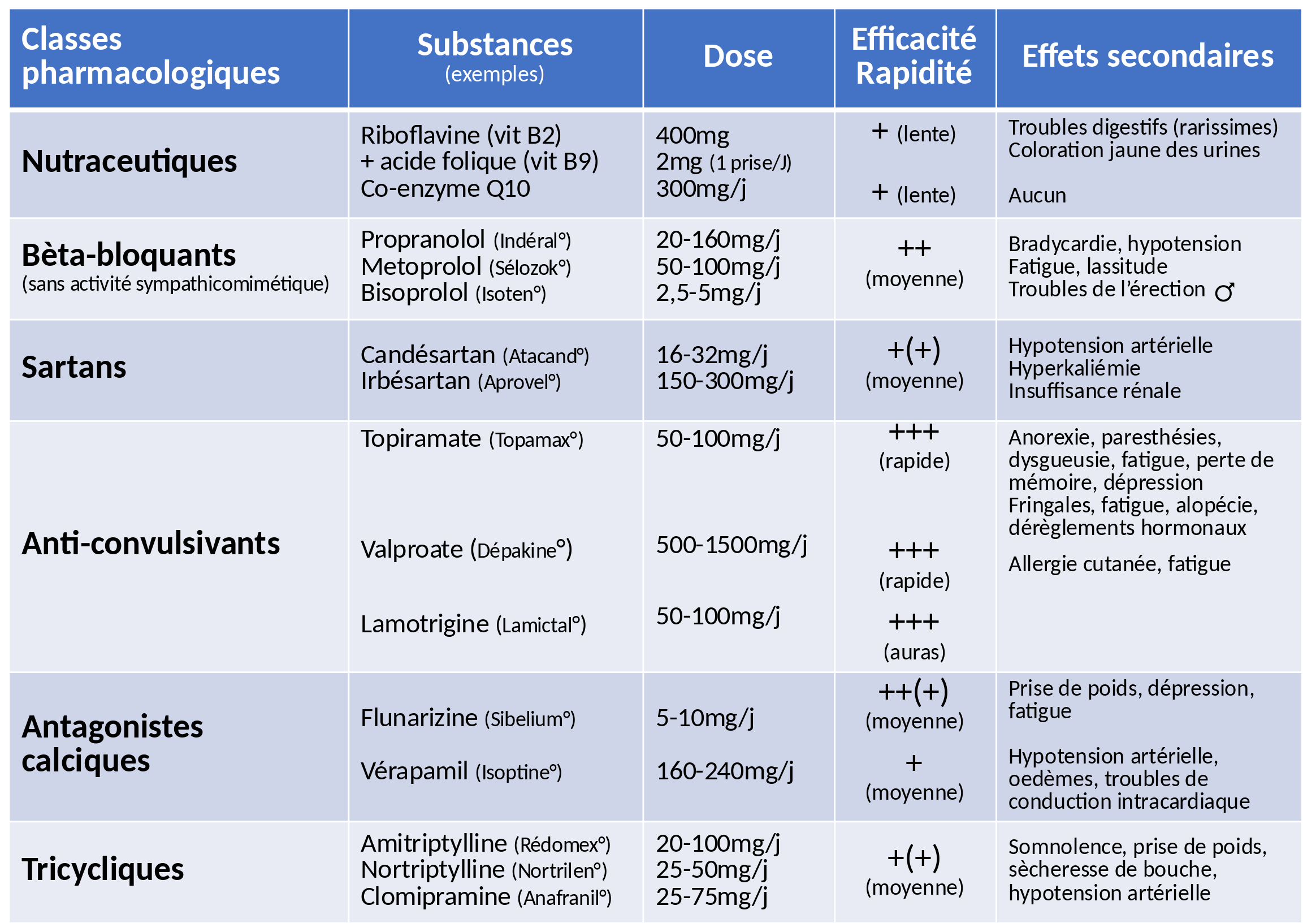
Malheureusement, l’efficacité des médicaments préventifs classiques est inférieure à 50 % dans la migraine épisodique de sorte que leur rapport efficacité sur effets secondaires n’est pas très favorable (Fig. 75). L’efficacité chute à 20 ou 30 % dans la migraine chronique (Paemeleire et al., 2015) et, par conséquent, il n’est pas surprenant qu’une étude américaine ait trouvé qu’un patient sur deux souffrant de migraine chronique abandonne le traitement par anticonvulsivants, bèta-bloquants ou tricycliques après deux mois (Hepp et al., 2017).
#15.2 « On m’a dit qu’il y avait un nouveau traitement ? Est-ce que je pourrais l’avoir… et est-ce que ça marche ? »
Les anticorps monoclonaux anti-CGRP
Les anticorps (Ac) monoclonaux bloquant la neurotransmission CGRP développés récemment occupent une place de choix dans l’arsenal thérapeutique antimigraineux moderne pour différentes raisons (Schoenen et al., 2020).
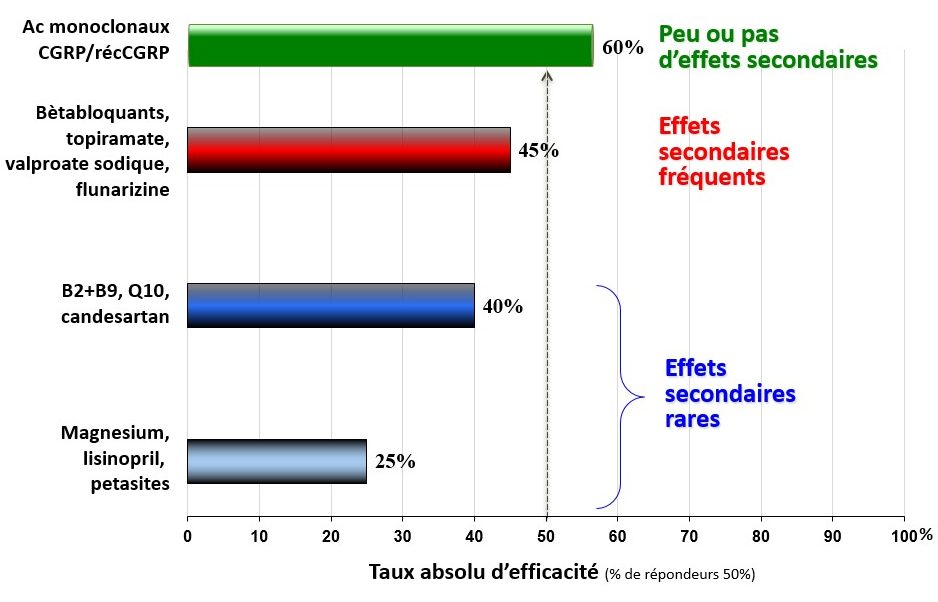
Il s’agit d’abord d’une réussite exemplaire de la recherche scientifique translationnelle, c’est-à-dire d’un aller-retour complémentaire et fructueux entre recherche fondamentale en laboratoire et recherche clinique chez les migraineux (Fig. 76). Mes quatre collègues (un Suédois, Lars Edvinsson ; un Danois, Jes Olesen ; un Australien, Peter Goadsby ; un Américain, Mike Moskowitz), qui y ont le plus contribué, viennent de se voir attribuer le Brain Prize 2021 de la Fondation Lundbeck, le prix internationalement le plus réputé et le mieux doté (1,3 million d’euros) pour la recherche sur le cerveau. Cette recherche a débuté il y a 35 ans par la découverte du CGRP (voy. supra, # 11) dans le système trigéminovasculaire des rongeurs.
En 1980, on a montré que le CGRP était augmenté dans le sang pendant la crise migraineuse et, en 1983, que cette augmentation disparaissait après l’injection d’Imitrex®. Ces découvertes, ajoutées à celle montrant en 2002 que l’injection intraveineuse de CGRP était capable de déclencher une crise chez les migraineux, ont incité les sociétés pharmaceutiques à chercher un médicament antimigraineux capable de bloquer le CGRP. Les premiers résultats positifs avec des antagonistes de petit poids moléculaire bloquant transitoirement le récepteur du CGRP (les « gépants ») (voy. Fig. 72) dans le traitement de la crise furent publiés en 2001.
Les premières publications sur l’effet préventif des Ac monoclonaux contre le CGRP ou son récepteur, molécules de gros poids moléculaire bloquant leurs cibles durant des semaines, datent de 2013. Il a encore fallu six ans pour finaliser tous les essais cliniques réglementaires prouvant l’efficacité et la sécurité de ces molécules avant l’autorisation de mise sur le marché accordée par les agences de médicaments américaine et européenne (Edvinsson et al., 2018).
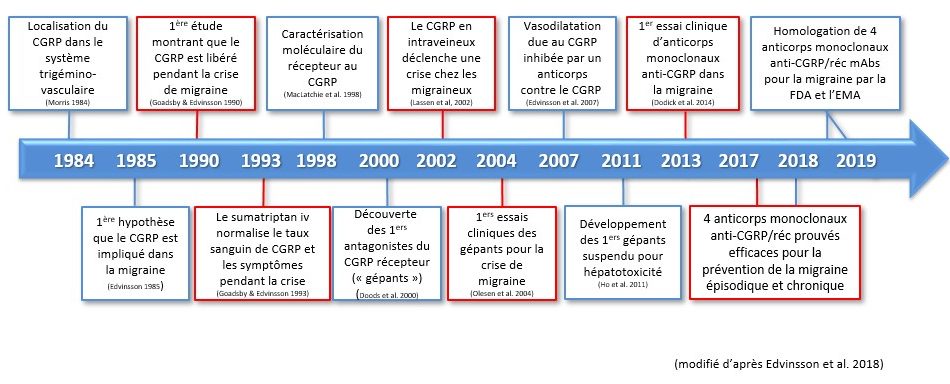
Quatre Ac monoclonaux bloquant l’action du CGRP développés par quatre firmes différentes sont actuellement disponibles (Fig. 77). Trois, l’eptinézumab (Vyepti®), le frémanézumab (Ajovy®) et le galcanézumab (Emgality®) sont dirigés contre le CGRP lui-même (« la clé ») ; un, l’érénumab (Aimovig®), bloque le récepteur du CGRP (« le trou de serrure ») et est le seul à 100 % semblable à un anticorps humain. Les Ac sont tous des immunoglobulines G, mais diffèrent par le sous-type, la posologie et le temps qu’il faut pour éliminer 50 % de la quantité mesurée dans le sang après l’injection (« la demi-vie »). C’est le frémanézumab qui a la demi-vie la plus longue. L’eptinezumab a le relatif désavantage qu’il doit être administré par voie intraveineuse alors que ses concurrents s’administrent en sous-cutané avec un auto-injecteur.
Les Ac monoclonaux anti-CGRP/réc sont à ce jour les traitements de fond qui ont le meilleur rapport efficacité/effets secondaires (Drellia et al., 2021). Contrairement à d’autres anticorps monoclonaux utilisés dans des maladies neurologiques, comme la sclérose en plaques, qui peuvent entraîner des effets secondaires graves, ils n’ont aucun effet sur le système immunitaire.
Leur tolérance est dès lors excellente. Ajoutez-y leur facilité d’utilisation (une dose injectée par mois ou une triple dose injectée tous les trois mois) et vous comprendrez qu’ils pourraient être un premier choix pour tous les migraineux qui nécessitent un traitement préventif.
La raison pour laquelle ils ne le sont pas est d’ordre pharmaco-économique, et non pas médical. Leur prix est, en effet, très élevé et la plupart des organismes publics de sécurité sociale considèrent qu’il faut limiter leur remboursement aux patients très invalidés qui ont au moins huit crises de migraine par mois et échoué à ≥ trois traitements préventifs classiques de classes pharmacologiques différentes (voy. Fig. 74).
Les résultats d’essais cliniques réalisés sur des milliers de patients convergent pour démontrer la remarquable efficacité de ces Ac monoclonaux. Après un traitement de trois mois, 48 % à 62 % des patients souffrant de migraine épisodique ont une réduction de 50 % du nombre de crises mensuelles (Schoenen et al., 2020) (Fig. 78).
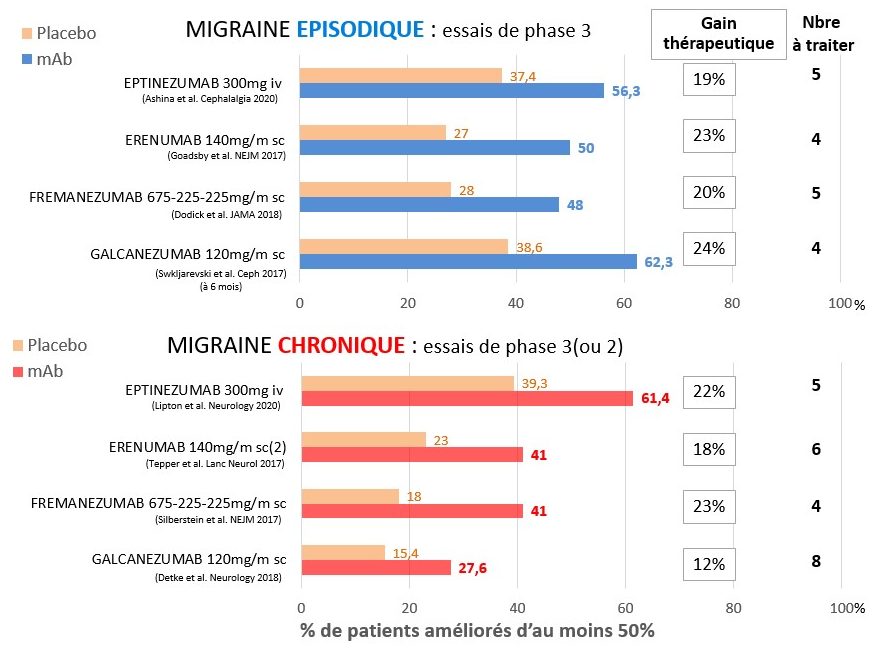
La variabilité est avant tout due à la réponse placebo différente suivant les études (entre 27 et 39 %) (Dodick, 2019). Si l’on soustrait la réponse placebo de celle du médicament pour obtenir le « gain thérapeutique » par rapport au placebo, les pourcentages de répondeurs 50 % ne varient plus que de 19 % à 24 %. Le nombre de patients à traiter avant d’observer un effet (1/gain thérapeutique, voy. infra, # 13.7) est donc en moyenne de 4 ou 5.
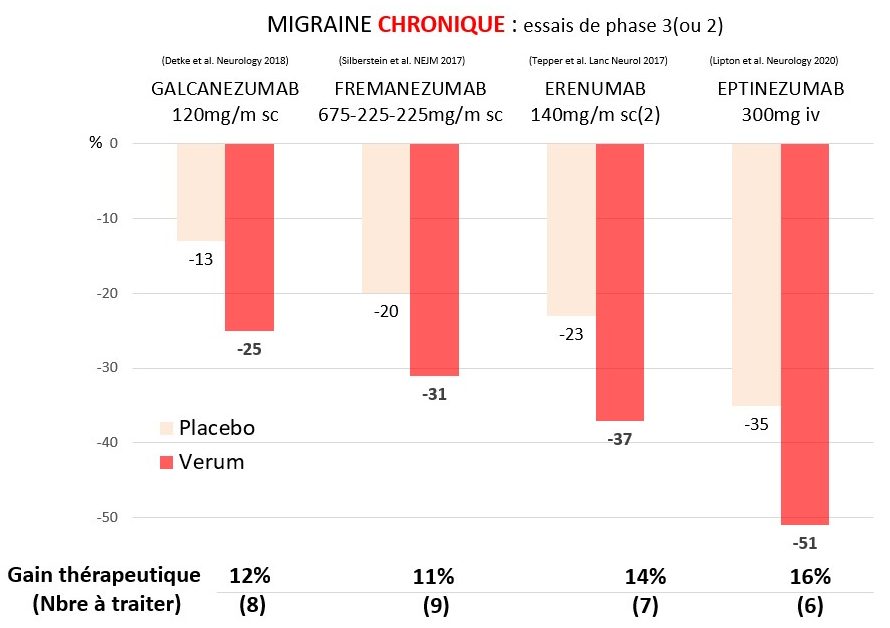
Ceci suggère qu’il n’y a guère de différence d’efficacité cliniquement significative entre les quatre Ac monoclonaux, mais jusqu’ici aucune étude ne les a comparés directement. Dans la migraine chronique, les scores thérapeutiques sont proches de ceux de la migraine épisodique (Fig. 78).
Si on prend comme mesure d’efficacité la diminution du nombre mensuel de jours de migraine (Fig. 79), le gain thérapeutique par rapport au placebo varie entre 16 % (eptinézumab) et 11 % (frémanézumab), et donc le nombre de patients à traiter entre 6 et 8. Les Ac monoclonaux n’ont par contre aucun effet sur les auras migraineuses qui peuvent même apparaître pour la première fois durant le traitement.
Dans toutes les études publiées (Dodick, 2019), les effets secondaires n’étaient pas plus nombreux pour les Ac monoclonaux anti-CGRP/réc que pour le placebo. Ceci dit, comme le CGRP dont ils bloquent l’effet dilate les vaisseaux, ce qui est bénéfique en cas de thrombose pour sauver les tissus de l’ischémie, il ne faut les utiliser qu’avec grande prudence chez quelqu’un qui souffre d’une pathologie cardio- ou cérébro-vasculaire. De plus, on a constaté chez quelques patients traités avec l’érénumab une élévation de la pression artérielle, surtout s’ils avaient déjà une légère hypertension avant le traitement : à surveiller. En attendant d’avoir plus de recul, ils sont contrindiqués pendant la grossesse, car ils pourraient perturber la bonne vascularisation du placenta.
Notre expérience
Avant la commercialisation des trois premiers Ac monoclonaux anti-CGRP en 2021, des patients belges fortement invalidés ont pu bénéficier d’un traitement par érénumab (Aimovig®) ou frémanézumab (Ajovy®) grâce à un programme d’usage compassionnel. Nous avons traité avec l’érénumab, 140 mg/mois en injection sous-cutanée, 156 migraineux qui avaient ≥ 4 jours de migraine par mois et déjà reçu sans succès ≥ 2 traitements préventifs classiques (Schoenen et al., soumis).
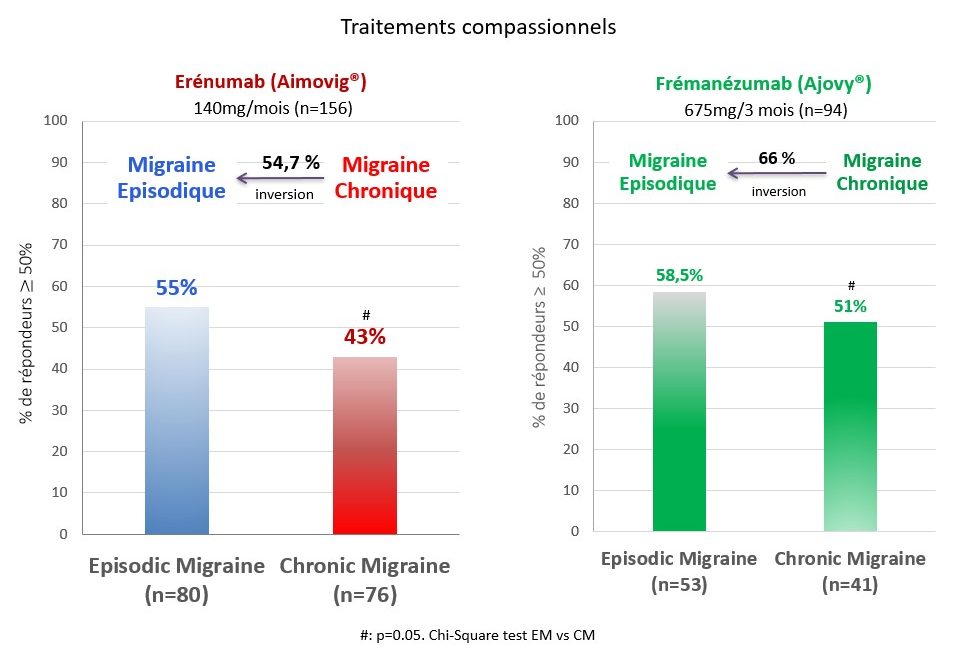
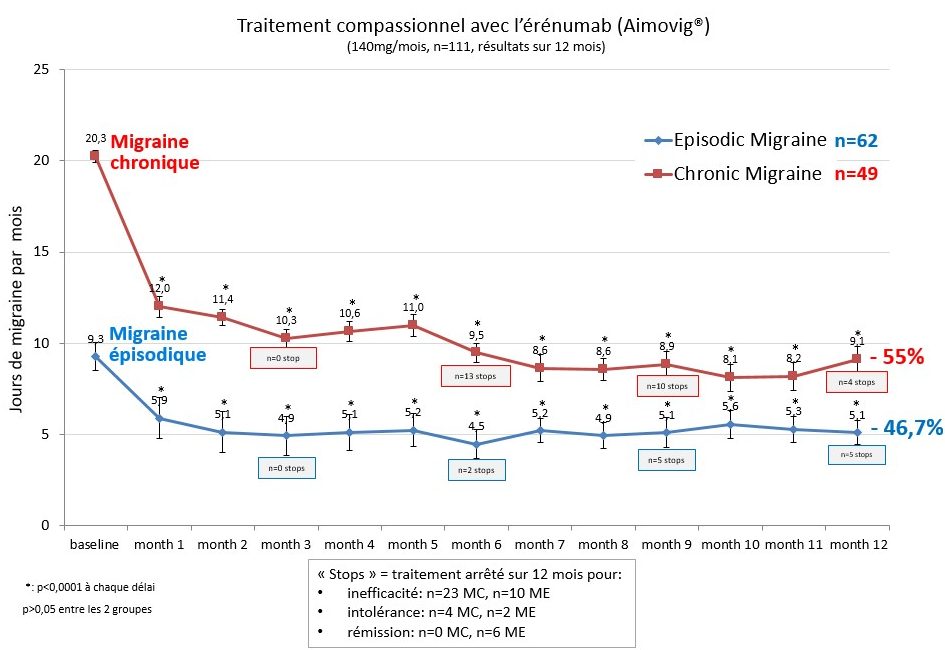
Les résultats obtenus sont très proches de ceux des essais cliniques (voy. Fig. 78-79). Chez les sujets souffrant de migraine épisodique, plus de 55 % ont eu une réduction de ≥ de 50 % des jours mensuels de migraine sans variation significative entre le 3e et le 12e mois de traitement.
Dans la migraine chronique, le résultat est significativement moins bon après trois mois (43 % de répondeurs), mais ceci est dû à la mauvaise réponse de patients souffrant de céphalées permanentes (13 % de répondeurs) (Fig. 80). L’érénumab réduit non seulement la fréquence des crises de migraine, mais aussi leur intensité et la consommation de médicaments de la crise dans les deux formes de migraine (Fig. 81).
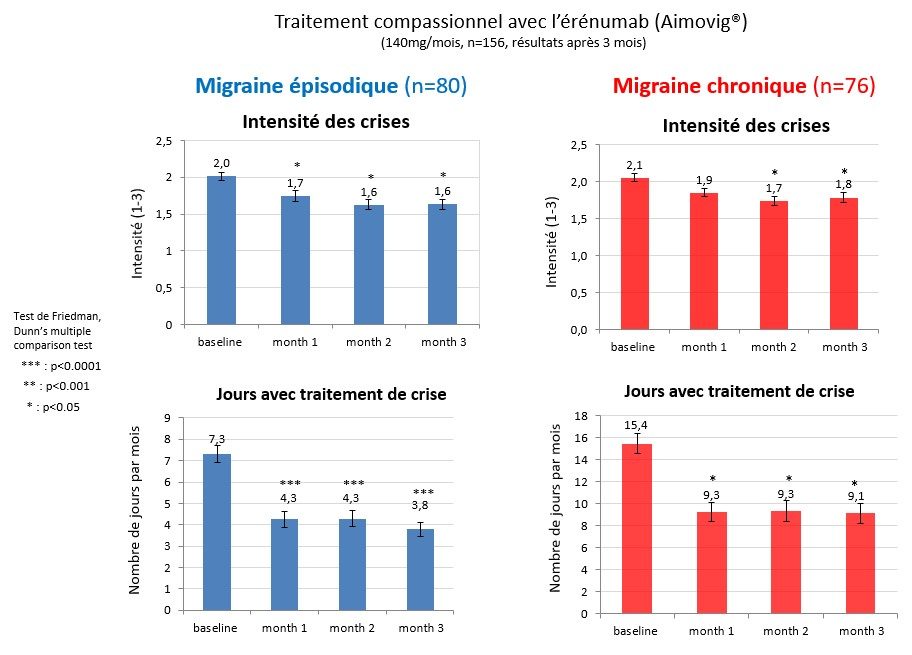
Le nombre mensuel de jours de migraine est déjà significativement abaissé un mois après la 1re injection d’érénumab, démontrant que l’effet thérapeutique est rapide. La diminution des jours de migraine ne se modifie guère entre trois mois et douze mois (Fig. 82).
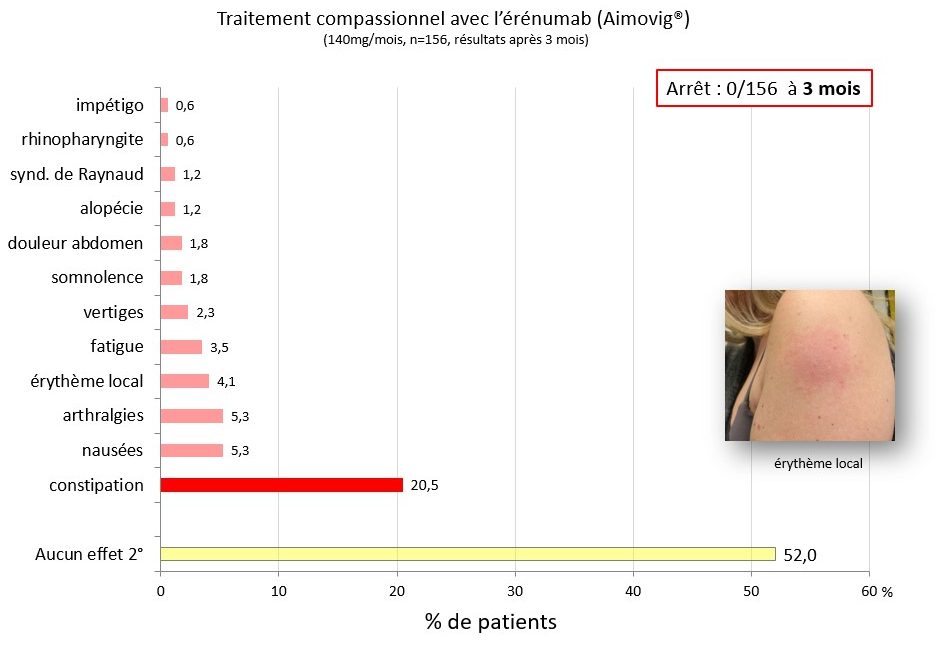
Au total, 23 patients (30 %) ont arrêté le traitement pour inefficacité après un suivi d’un an dans le groupe migraine chronique, mais seulement 10 (12,5 %) dans la migraine épisodique. Après un an, il n’y a que 6 patients sur 156 (3,8 %) qui ont abandonné le traitement pour effets secondaires, confirmant que, comme dans les essais cliniques, les effets indésirables de l’érénumab sont rares et transitoires (Fig. 83). La constipation fut le plus fréquent ; elle a été rapportée par 21 % des patients dont la plupart en avaient déjà avant le traitement et l’ont gérée par les moyens habituels. Neuf sujets ont présenté de légères douleurs articulaires ou de discrètes nausées pendant quelques jours après l’injection d’érénumab ; sept ont développé une réaction cutanée érythémateuse transitoire à l’endroit d’injection du produit (voy. encart de la Fig. 83).
Nonante-quatre patients ayant ≥ 8 jours de migraine par mois et en échec de ≥ 2 traitements préventifs classiques ont été traités par frémanézumab (Ajovy®) à raison d’une injection sous-cutanée de 675 mg tous les trois mois. Les résultats sont comparables à ceux obtenus avec l’érénumab : 58,5 % de répondeurs 50 % dans la migraine épisodique (n=53), 51 % dans la migraine chronique (n=41). Au total, quinze patients (16 %) ont abandonné le traitement pour inefficacité après neuf mois de traitement, trois (3,2 %) seulement pour non-tolérance.
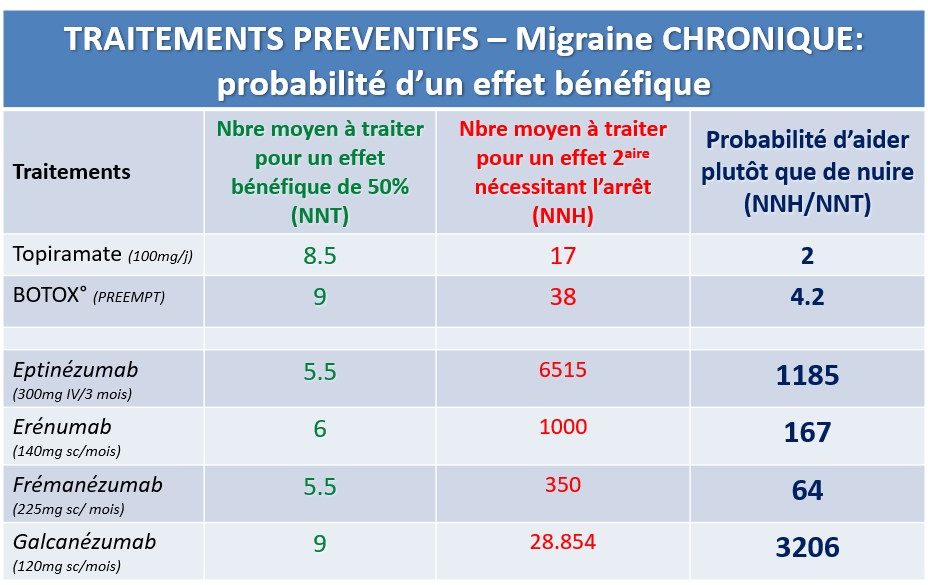
Notre expérience confirme ainsi que les Ac monoclonaux anti-CGRP se distinguent des traitements préventifs précédents par une probabilité nettement plus grande d’apporter un bénéfice au migraineux que de lui occasionner des effets indésirables (exprimé par le rapport entre le nombre de patients à traiter pour induire un effet 2° et celui nécessaire pour obtenir un effet bénéfique), ce qui est illustré dans la figure 84 pour la migraine chronique : la probabilité d’aider un migraineux chronique sans induire d’effets secondaires sévères est respectivement 500 fois ou 200 fois plus grande avec les Ac monoclonaux qu’avec le Topamax® ou des injections péricrâniennes de Botox® (Drellia et al., 2021).
À cause de leur poids moléculaire élevé, les Ac monoclonaux anti-CGRP/réc ne pénètrent quasi pas dans le cerveau lui-même. Ils agissent au niveau du système trigéminovasculaire dans les méninges où se trouvent aussi les cibles de la plupart des traitements de crise (voy. Fig. 54). La principale différence avec ces derniers est que les Ac monoclonaux exercent leur effet pendant des semaines voire des mois. Ils agissent comme un traitement de crise de longue durée, mais n’ont aucun effet sur les mécanismes étiopathogéniques centraux de la migraine (voy. supra, # 11), ce qui explique sans doute pourquoi ils n’améliorent pas les auras et qu’ils peuvent laisser persister chez certains patients des crises « fantômes », c’est-à-dire une sensation de crise sans céphalée. Le modèle de l’entonnoir (Fig. 85) (Schoenen et Sándor, 2003) permet de comprendre ce nouveau paradigme et aussi pourquoi les traitements de crise, y compris les Ac monoclonaux anti-CGRP/réc, qui bloquent la voie finale commune de la cascade migraineuse (à l’extrémité de l’entonnoir) sont globalement plus efficaces que les traitements préventifs qui doivent cibler une variété de facteurs étiopathogéniques différents (à l’entrée large de l’entonnoir).
Figure 85 : Différence d’efficacité des traitements anti-migraineux expliquée par le modèle de l’entonnoir
#15.3 « Que me conseillez-vous, docteur ? »
Le traitement préventif antimigraineux par paliers
Le traitement préventif par paliers (Fig. 86) vise à adapter la stratégie thérapeutique à chaque migraineux individuellement selon son profil (voy. Fig. 68) et la sévérité de la maladie (voy. Fig. 36) (Ashina et al., 2021). Cela se justifie parce que les différents traitements diffèrent par le rapport efficacité/effets secondaires, le prix et les critères de remboursement par la sécurité sociale. Si les crises sont peu fréquentes (2-4 jours/mois), nous conseillons d’essayer d’abord un traitement par un nutraceutiques (vitamines B2 et B9 combinées ou co-enzyme Q10) (Schoenen et al., 1998 ; Sándor et al., 2005) et/ou un traitement non médicamenteux (voy. infra, # 13.5). Ces traitements ont, en effet, un rapport efficacité/effets 2° acceptable, mais ne sont pas remboursés par l’INAMI (palier 1).
Figure 86 : Le traitement préventif « par paliers »
S’il n’y a pas d’amélioration après six à huit semaines ou si le migraineux a 5-7 jours de céphalée par mois, on peut y ajouter un bèta-bloquant efficace dans la migraine ou un sartan en tenant compte des contrindications liées aux effets 2° (voy. Fig. 74) (palier 2).
Si la migraine est de haute fréquence (8-14 jours/mois) ou si le traitement de 2e palier n’est pas efficace, nous préconisons le topiramate en avertissant le patient des effets 2° fréquents de ce médicament et surtout du risque d’une action délétère sur l’humeur et la mémoire qui nécessite son arrêt (palier 3). Le valproate sodique a une efficacité semblable au topiramate, mais un profil d’effets 2° différent ; il est contrindiqué chez les femmes, sauf exception et après la ménopause, mais conserve une place chez les hommes migraineux qui le tolèrent nettement mieux. Les tricycliques peuvent être utiles à ce stade, surtout chez les patients qui souffrent en plus de céphalées de tension (voy. Fig. 27) et/ou de troubles anxio-dépressifs (voy. Fig. 43). Comme signalé ci-devant, les Ac monoclonaux anti-CGRP/réc ont le meilleur rapport efficacité/effets 2° et seront les traitements de premier choix dans la migraine de haute fréquence et la migraine chronique, là où ils sont sur le marché et remboursés, et surtout si les autres traitements préventifs sont restés inefficaces.
La migraine chronique (palier 4) est notoirement réfractaire aux médicaments préventifs. Heureusement, les Ac monoclonaux offrent un nouvel espoir dans cette forme invalidante de migraine en l’améliorant chez près de 50 % des patients. La migraine chronique peut aussi être traitée par injections péricrâniennes multiples de toxine botulique (Botox®) tous les trois mois avec un succès thérapeutique d’environ 30 à 40 % (Schoenen, 2010), alors que le Botox® est inefficace dans la migraine épisodique (Relja et al., 2007).
La lamotrigine (Lamictal®) occupe une place à part dans l’arsenal thérapeutique antimigraineux. Elle est un 1er choix pour la migraine avec aura de haute fréquence, car c’est un des inhibiteurs les plus puissants de la dépression corticale envahissante (voy. supra, # 11) (Bogdanov et al., 2011) ; elle n’a pas d’intérêt dans la migraine sans aura. L’acétazolamide (Diamox®), un inhibiteur de l’anhydrase carbonique, et la flunarizine (Sibelium®), un antagoniste calcique, sont parfois des alternatives utiles.
Chez les enfants, il faut privilégier des médicaments préventifs dépourvus d’effets secondaires, comme la riboflavine, le co-enzyme Q10, ou des traitements non médicamenteux (voy. infra, # 13.5) (Lantéri-Minet et al., 2014). Un bèta-bloquant à dose adaptée peut être utile en surveillant la tolérance cardio-vasculaire.
Si un traitement de 2e palier est nécessaire, on peut utiliser la flunarizine qui est mieux tolérée par les enfants que par les adultes. Plus rarement, force est de recourir au topiramate, notamment dans la migraine chronique. À ce jour, il n’y a pas encore d’études publiées des Ac monoclonaux anti-CGRP/réc chez les enfants ou les adolescents.

